El aprendizaje de las ciencias naturales puede mejorarse con la visualización de fenómenos a través de experiencias. Es evidente que la mayoría de las escuelas no tienen los recursos para llevar a cabo experimentos hasta relativamente simples, en vista del costo del equipo, pero existen soluciones económicas alternativas que merecen ser analizadas. Te mostraremos algo.
Nota: Este artículo es muy actual, principalmente debido a la necesidad de incluir el uso de las tecnologías modernas en la enseñanza de la ciencia.
Este artículo está destinado a profesores de ciencia, física y química del nivel medio que quieran tener un ingreso mucho más alto en sus clases, con la realización de experiencias interesantes, que puedan ilustrar los fenómenos estudiados.
Los equipamientos propios para la realización de muchos experimentos son caros y no existen en la mayoría de las escuelas, pero describimos una alternativa de bajo costo para la realización de experiencias en el campo de la fisicoquímica y electroquímica.
Además de muy sencillo de montar, los efectos obtenidos son muy atractivos, despertando incluso el interés de los estudiantes en esta área de conocimiento.
¡Los futuros científicos son generados a partir de experiencias muy sencillas de iniciación y nuestro país lo necesita!
Usando solamente una lámpara común y un diodo (que puede incluso ser aprovechado de viejos aparatos), describimos una fuente experimental para los experimentos físico - químicos y algunas de las demostraciones interesantes que los profesores (y los estudiantes) pueden realizar.
El montaje también es válido como sugerencia de un excelente trabajo para ferias científicas.
El equipo
El equipo consiste simplemente en dos piezas conectadas, para formar una fuente actual continua.
De hecho, en la toma de corriente tenemos corriente alterna y sin ninguna limitación de intensidad, que además de inconveniente para los experimentos es incluso peligrosa.
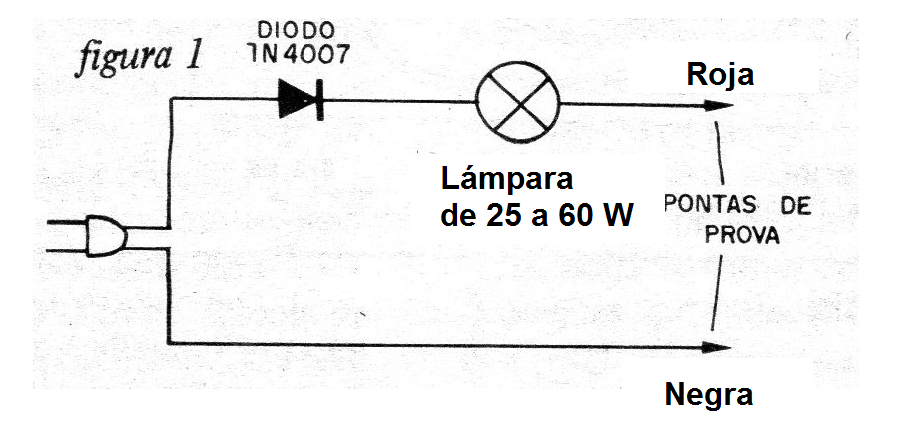
Lo que hacemos entonces es utilizar una bombilla común de 25 watts a 60 watts para limitar la corriente y un diodo semiconductor para rectificar.
En la figura 1 tenemos el diagrama completo de nuestro "equipo".
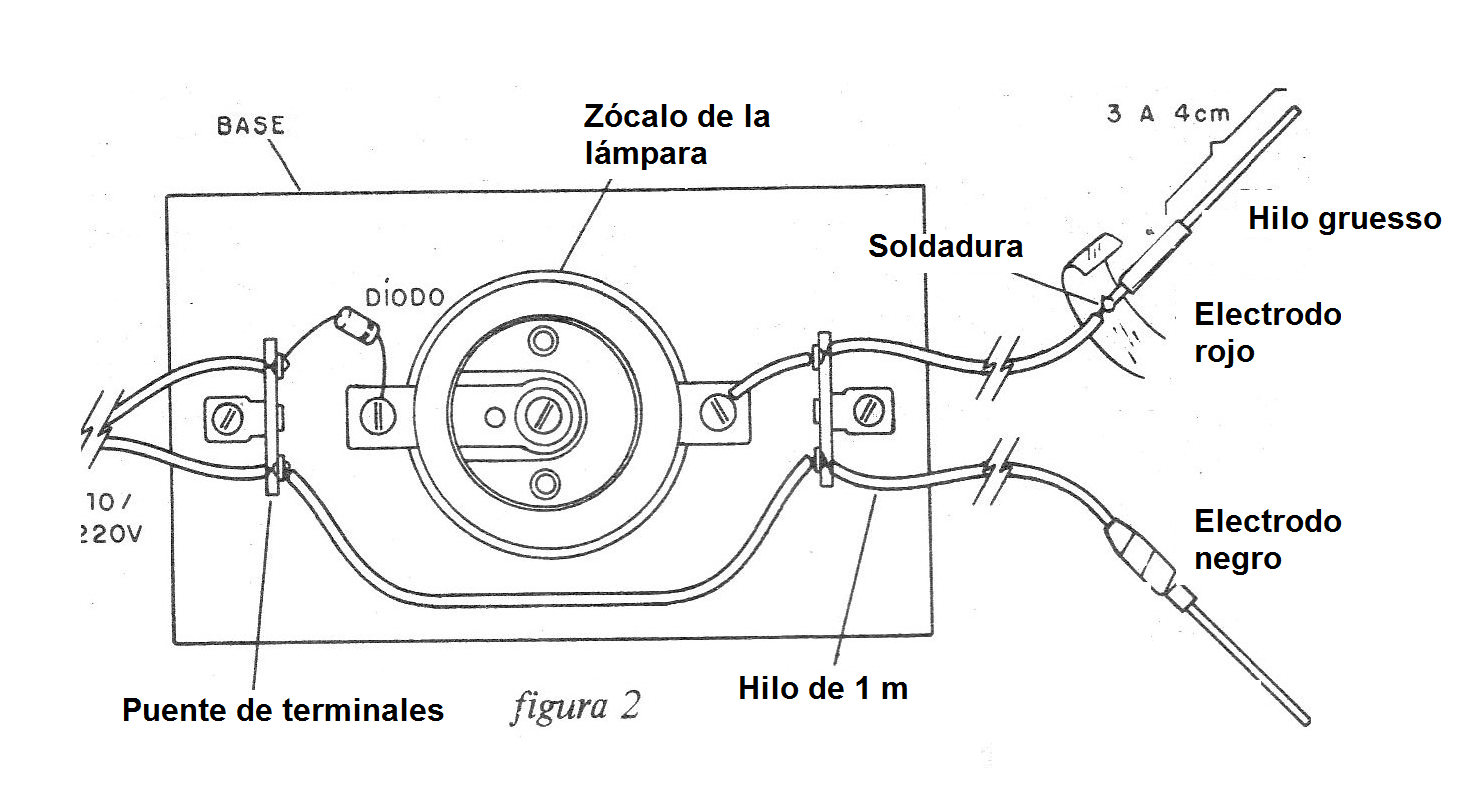
Su montaje se puede hacer sobre una base de madera, como se muestra en la figura 2.
Las puntas de prueba no son más que dos trozos de alambre grueso, en los que desencapamos aproximadamente 3 o 4 cm de uno de los extremos.
En el otro extremo de cada punta, soldamos el alambre de conexión y aislamos el lugar con cinta aislante, para mayor seguridad.
Es muy importante que las partes metálicas del aparato no estén expuestas porque un contacto accidental puede causar un choque o un cortocircuito.
Prueba inicial
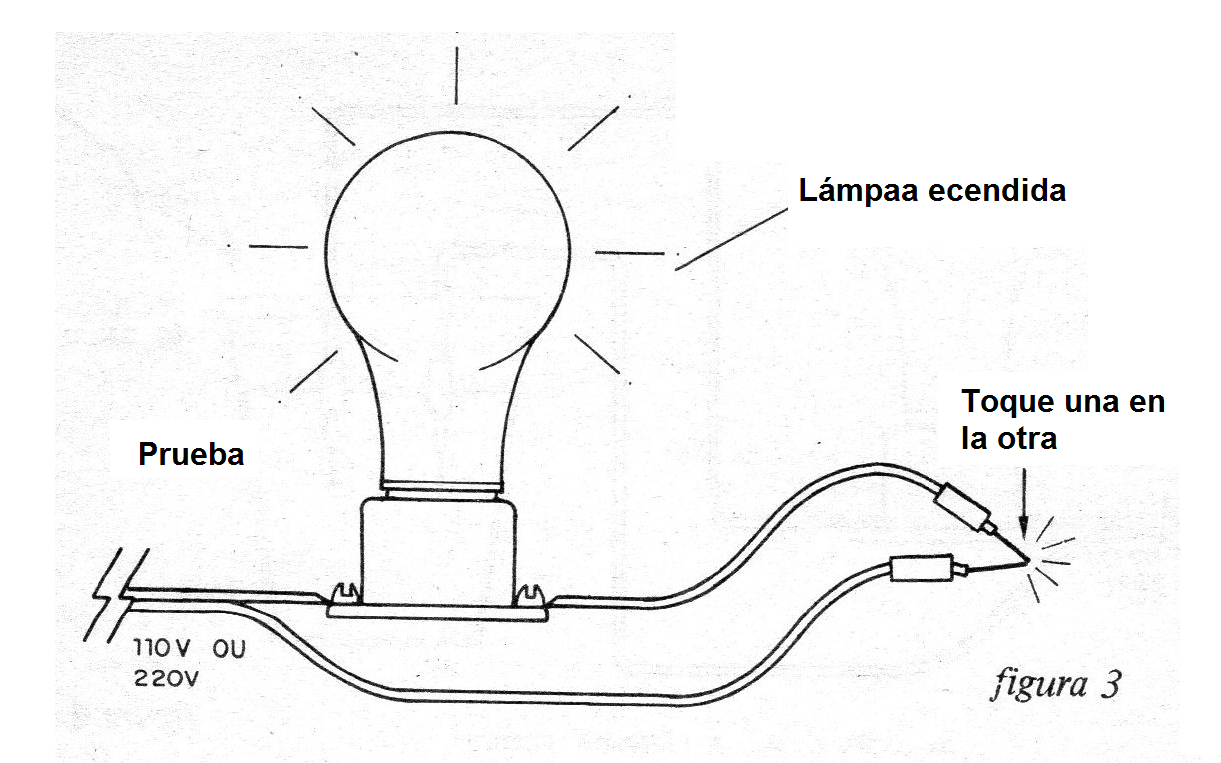
Después de haber montado su aparato, para probar simplemente conecte el cable a la toma de corriente.
Coloque la lámpara en el soporte y junte una punta de prueba en la otra. La lámpara debe encenderse. (figura 3)
Lo que ocurre en este caso es que hay continuidad en el circuito que se cierra, y una corriente continua va a alimentar la lámpara.
Observe que la lámpara se ilumina con aproximadamente la mitad de su brillo total. Esto se debe a que el diodo sólo permite pasar, la mitad de los semiciclos de alimentación.
Experiencia 1 – Conductividad de soluciones
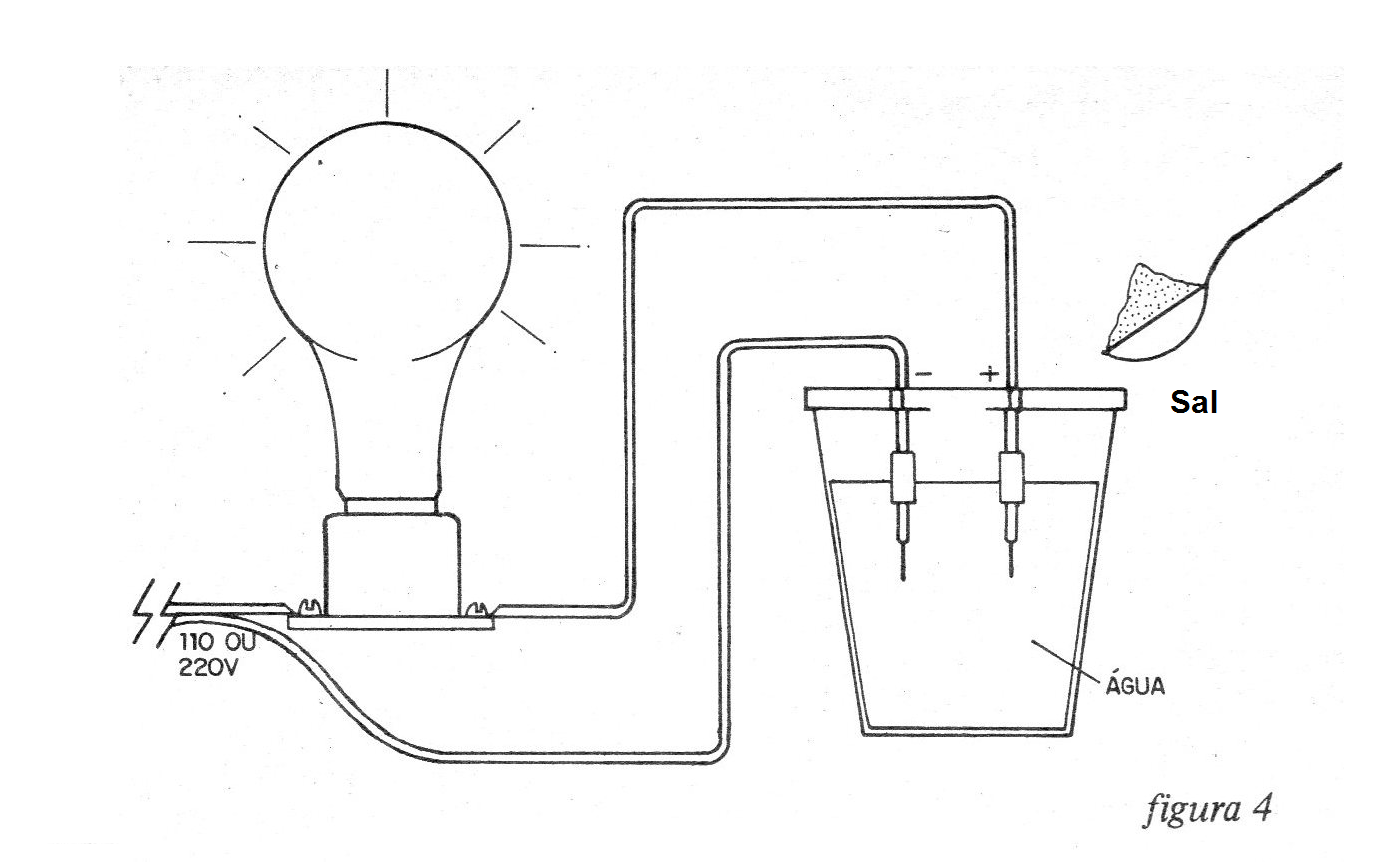
Con esta experiencia el profesor puede demostrar que el agua pura es un buen aislante y que el agua con sales, ácidos o bases disueltas, llega a ser conductora de electricidad.
En un vaso de agua corriente (o agua destilada), colocamos los electrodos de nuestro equipo como se muestra en la figura 4.
El agua del grifo o las fuentes no son químicamente puras, ni siquiera la lluvia que contiene muchas impurezas, por lo que ambos no son un aislante perfecto.
La lámpara puede mostrar los signos de calentamiento de su filamento que viene a "enrojecimiento" en algunos casos. El ideal es utilizar agua destilada, pero el agua común también proporciona resultados satisfactorios, porque su concentración de impurezas es pequeña.
La lámpara en la configuración inicial será completamente apagada, pero en el momento en que lancemos una cucharada de sal u otras sustancias al agua, habrá la transformación inmediata de sus propiedades y se convertirá en conductora, haciendo que la lámpara se ilumine.
Explique a los alumnos que la iluminación de la lámpara se debe al hecho de que el agua se convierte en conductora en las condiciones indicadas y no en el hecho de que está generando alguna forma de energía.
Experiencia 2 - Electrólisis
Dejando los electrodos en la solución (agua y sal) la corriente que circulará provoca reacciones químicas interesantes. Estas reacciones que se producen con el soporte de las corrientes eléctricas se denominan "electrólisis".
Después de unos minutos, el aparato hará que el agua se desdibuje con coloración azulada, además de la formación de Sal en la parte inferior del vaso.
Estas sales se deben a la descomposición del cobre que se combina con cloro (de la sal), resultando en sales como el cloruro de cobre y otras que los profesores de química pueden explicar mejor escribiendo las reacciones involucradas.
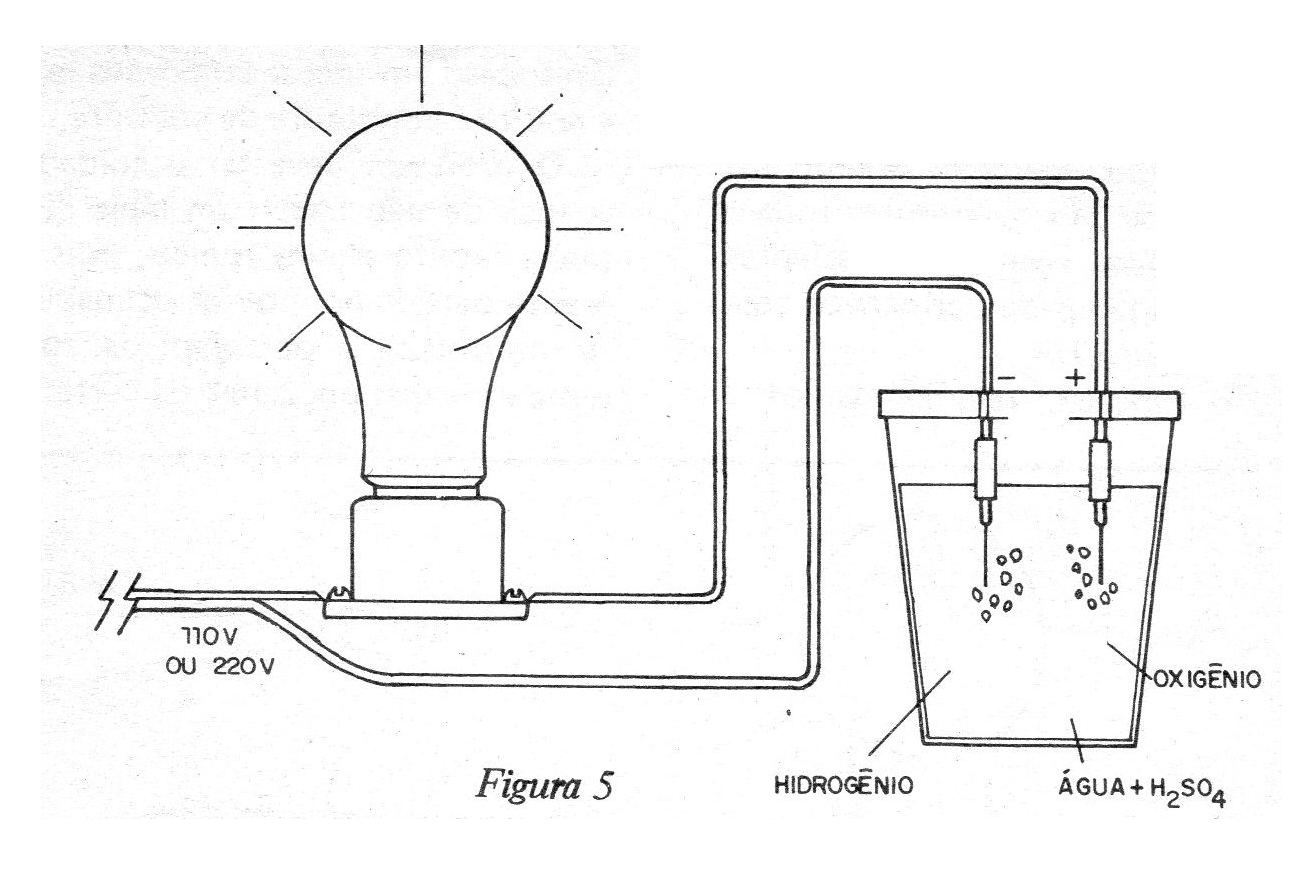
Experimento 3 - Formación de hidrógeno
La electrólisis del agua se puede hacer si en vez de disolver la sal en el vidrio con este líquido, utilizamos una pequeña cantidad de ácido sulfúrico (que se puede obtener en farmacias o en el laboratorio de la escuela).
¡Tenga cuidado al trabajar con el ácido! Pingue sólo unas pocas docenas de gotas cuidadosamente en el vaso! En este caso, las burbujas que salen del polo negativo (punta negra), serán de hidrógeno y las que salgan del polo positivo, serán de oxígeno. (figura 5)
La turbidez de la solución se debe a las reacciones que se producen con el cobre de los electrodos (de hecho su desgaste requiere que periódicamente se intercambien).
La reacción de la formación de los gases del agua es:
2H2O 2H2 + O2
Una mejora a este experimento es utilizar como electrodos, carbones quitados de las pilas cuidadosamente y limpiado correctamente.
En este caso, la reacción que corroe el electrodo no ocurre.
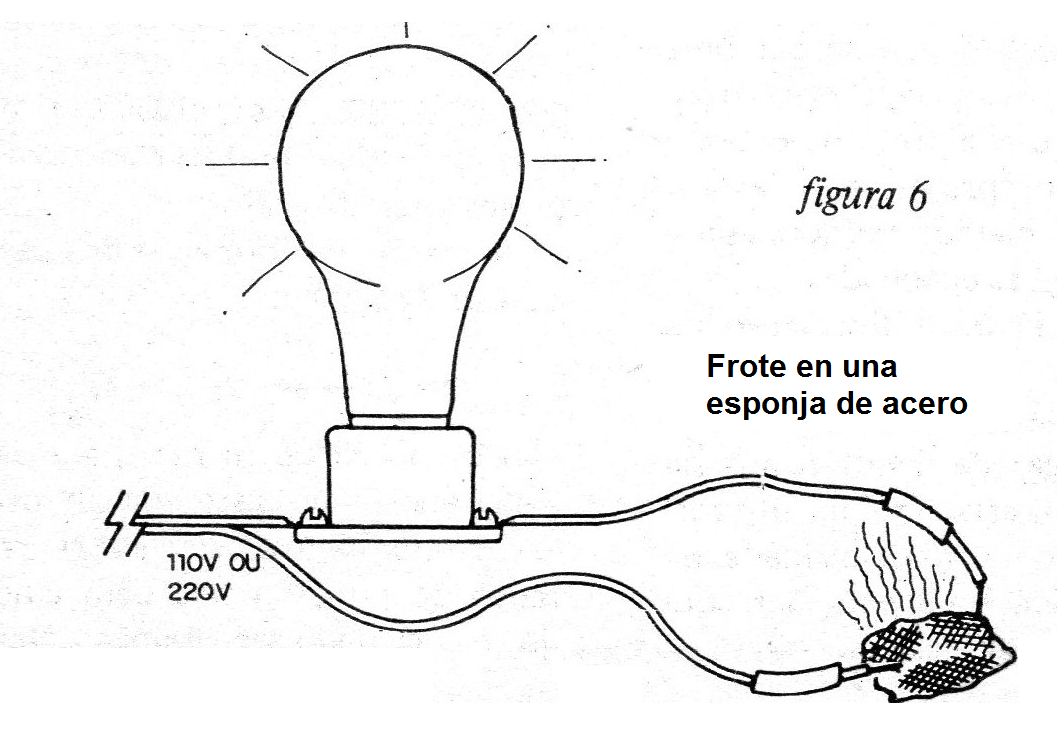
Experiencia 4 - Ignición eléctrica
¡Frotar los electrodos en un trozo de esponja de acero y vea el resultado!
La combustión instantánea de este material por el efecto de la corriente. (figura 6)
Lo que pasa es que la corriente que circula a través de los finos filamentos de la esponja de acero, provoca su calentamiento (efecto térmico de la corriente) y consecuente inflamación.
Al soplar el material durante el experimento, genera la combustión completa de la esponja de acero.
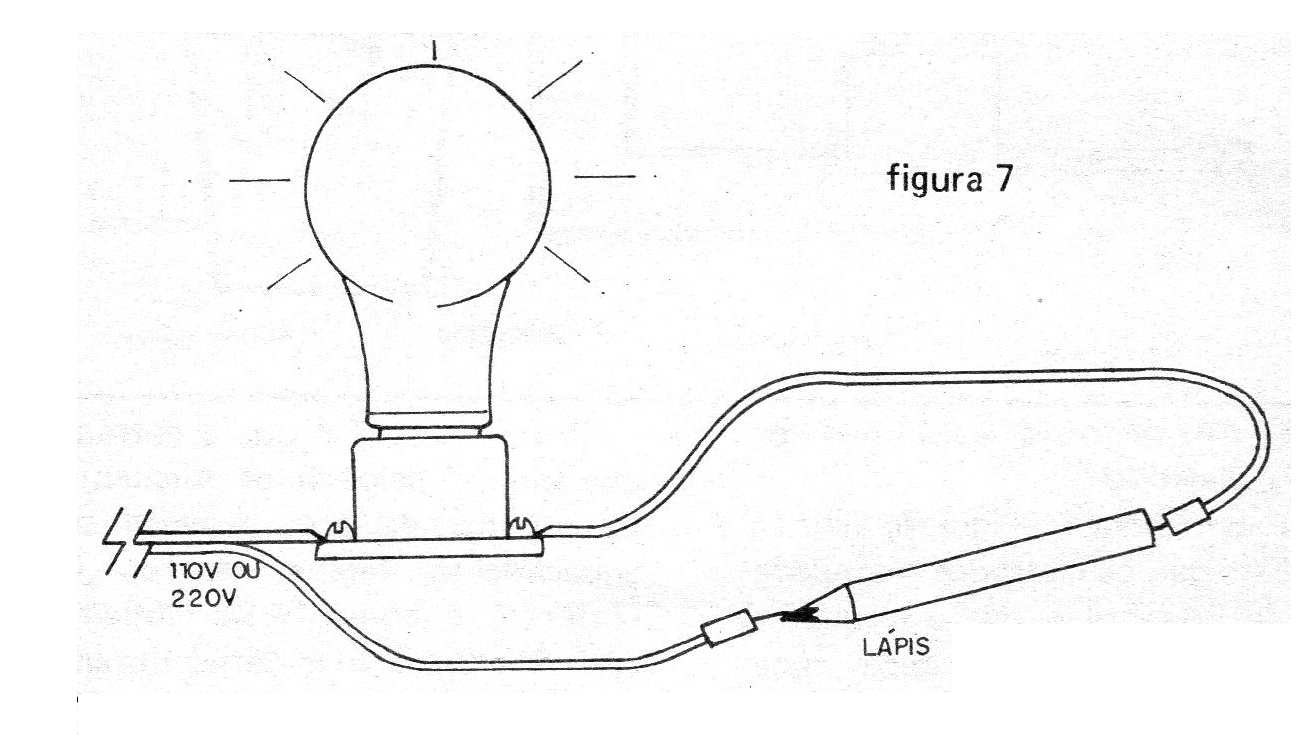
Experiencia 5 – Identificación de conductores y aisladores
Al tocar las puntas de prueba en diferentes materiales podemos averiguar si son conductores (cuando la lámpara se enciende) o aisladores (cuando la lámpara permanece apagada). (figura 7)
En particular, se recomienda realizar el experimento con un lápiz, en cuyo caso se comprueba que el grafito es conductor de corriente.
El profesor debe tener cuidado de no tomar un lápiz que ha tomado un poco de caída, porque el grafiti roto en el interior de la madera interrumpe el paso de la corriente y la experiencia no funciona.